Hukum Pertama Termodinamika
Perubahan energi dalam: 

Keterangan:
 :Perubahan energi dalam (Joule)
:Perubahan energi dalam (Joule)- U2:Energi dalam pada keadaan akhir (Joule)
- U1:Energi dalam pada keadaan awal (Joule)
Usaha yang dilakukan oleh gas pada tekanan tetap:
Keterangan:
- p: Besarnya tekanan (atm)
 : Perubahan volume (liter)
: Perubahan volume (liter)
Rumus umum usaha yang dilakukan gas: 

Penghitungan energi dalam:
- Gas monoatomik:

- Gas diatomik:

Proses-proses termodinamika gas
Proses isobarik
Proses isobarik adalah perubahan keadaan gas pada tekanan tetap.
Persamaan keadaan isobarik: 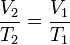
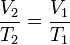
Usaha yang dilakukan pada keadaan isobarik: 

Proses isokhorik
Proses isokhorik adalah perubahan keadaan gas pada volume tetap.
Persamaan keadaan isokhorik: 

Proses isotermis/isotermik
Proses isotermik adalah perubahan keadaan gas pada suhu tetap.
Persamaan keadaan isotermik: 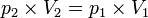
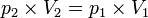
Usaha yang dilakukan pada keadaan isotermik:
- Dari persamaan gas ideal

- Rumus umum usaha yang dilakukan gas:

maka: 

karena 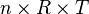 bernilai tetap, maka:
bernilai tetap, maka:
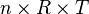 bernilai tetap, maka:
bernilai tetap, maka:
Ingat integral ini!


maka persamaan di atas menjadi
maka menjadi:
Proses adiabatik
Proses adiabatik adalah perubahan keadaan gas dimana tidak ada kalor yang masuk maupun keluar dari sistem.
Persamaan keadaan adiabatik: 

Tetapan Laplace: 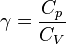
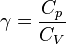
karena  , maka persamaan diatas dapat juga ditulis:
, maka persamaan diatas dapat juga ditulis:
 , maka persamaan diatas dapat juga ditulis:
, maka persamaan diatas dapat juga ditulis:
Usaha yang dilakukan pada proses adiabatik: 

Sumber
Kanginan, Marthen (2002). Fisika Untuk SMA Kelas XI Semester 2. Erlangga. ISBN 978-979-015-273-1.


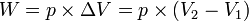



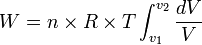
![W = n \times R \times T \times[\ln V_2 - \ln V_1]](http://upload.wikimedia.org/math/0/a/7/0a71834fa480baf975b62a9a64bb7b7d.png)


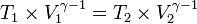




0 komentar:
Speak up your mind
Tell us what you're thinking... !