Hukum I Termodinamika - Sebelumnya kita sudah membahas Sifat-sifat Gas Ideal, sekarang kita akan membahas Hukum Pertama Temodinamika. Hukum I Termodinamika merupakan materi Fisika SMA Kelas XIsemester genap yang cukup sulit untuk dipahami, jadi perlu perhatian khusus pada materi ini.
1. Hukum I Termodinamika
Apa yang kalian perkirakan akan terjadi jika sejumlah gas dalam suatu ruang tertutup dipanaskan? Keadaan yang langsung bisa dilihat suhunya naik dan mungkin volumenya bertambah. Kejadian inilah yang dijelaskan pada hukum I Termodinamika.
“Pada saat gas dalam ruang tertutup diberi kalor maka kalor tersebut akan dimanfaatkan untuk melakukan usaha dan merubah energi dalamnya.”
Hubungan di atas dapat dinamakan kekekalan energi dan dituliskan sebagai berikut.
Dengan :
untuk gas ideal monoatomik berlaku persamaan berikut.
atau
2. Proses-proses termodinamika
Proses termodinamika adalah perubahan keadaan gas, yaitu tekanan, volume dan suhunya. Perubahan ini diiringi dengan perubahan kalor, usaha dan energi dalamnya. Proses-proses yang memiliki sifat-sifat khusus ada empat contoh seperti berikut.
a. Proses Isobarik
Proses isobarik adalah proses perubahan gas dengan tahanan tetap. Pada garis P – V proses isobarik dapat digambarkan seperti pada berikut.
Proses Isobarik
Usaha proses isobarik dapat ditentukan dari luas kurva di bawah gra fik P – V.
b. Proses Isotermis
Proses isotermis adalah proses perubahan gas dengan suhu tetap. Perhatikan gra fikk pada Gambar berikut.
Proses isotermis adalah proses perubahan gas dengan suhu tetap. Perhatikan gra fikk pada Gambar berikut.
Proses Isotermis
Pada proses ini berlaku hukum Boyle.
Karena suhunya tetap maka pada proses isotermis ini tidak terjadi perubahan energi dalam 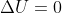 . Sedang usahanya dapat dihitung dari luas daerah di bawah kurva, besarnya seperti berikut.
. Sedang usahanya dapat dihitung dari luas daerah di bawah kurva, besarnya seperti berikut.
c. Proses Isokhoris
Proses isokhoris adalah proses perubahan gas dengan volume tetap. Pada grafik P.V dapat digambarkan seperti pada Gambar berikut.
Proses Isokhoris
Karena volumenya tetap berarti usaha pada gas ini nol, W = 0.
d. Adiabatis
Pada proses isotermis sudah kalian ketahui, U = 0 dan pada proses isokoris, W = 0. Bagaiaman jika terjadi proses termodinamika tetapi Q = 0 ?
Proses adiabatis
Proses yang inilah yang dinamakan proses adiabatis. Berdasarkan hukum I Termodinamika maka proses adiabatis memiliki sifat dibawah.
e. Proses lain dan gabungan proses
Proses-proses selain 4 proses ideal diatas dapat terjadi. Untuk memudahkan penyelesaian dapat digambarkan grafik P – V prosesnya. Dari grafik tersebut dapat ditentukan usaha proses sama dengan luas kurva dan perubahan energi dalamnya 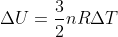 . Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum I termodinamika secara menyeluruh.
. Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum I termodinamika secara menyeluruh.











0 komentar:
Speak up your mind
Tell us what you're thinking... !