Sifat-sifat Gas Ideal – Pembahasan kali ini adalah Sifat-sifat Gas Ideal untuk materi Fisika SMA Kelas 11, di sini akan dibahas pengertian gas ideal, persamaan umum gas dan Azas Ekuipartisi.
1. Pengertian gas ideal
Seperti yang telah diketahui fase zat ada tiga yaitu padat, cair dan gas. Udara merupakan contoh dari fase gas. Gas ideal merupakan kumpulan dari partikel-partikel suatu zat yang jaraknya cukup jauh dibandingkan dengan ukuran partikelnya. Partikel-partikel itu selalu bergerak secara acak ke segala arah. Pada saat partikel-partikel gas ideal itu bertumbukan antar partikel atau dengan dinding akan terjadi tumbukan lenting sempurna sehingga tidak terjadi kehilangan energi. Apa yang dinamakan gas monoatomik? mono berarti satu atomik berarti atom. Jadi gas monoatomik berarti gas yang partikel-partikelnya berupa atom tunggal. Contoh gas monoatomik adalah gas helium,neon, dan argon. Untuk kelas XI SMA ini masih dibatasi gas monoatomik. Sebenarnya ada gas yang lain, seperti gas diatomik; oksigen (O2), Nitrogen (N2), dan ada lagi gas triatomik; Karbondioksida (CO2) dan uap air (H2O). Untuk mengetahui sifat-sifat lain tentang gas monoatomik dapat kalian cermati penjelasan berikut.
2. Persamaan umum gas
Pernah melihat atau mendengar alat masak Preswere Cooler (Presto)? Alat tersebut digunakan untuk memasak dengan memanfaatkan tekanan gas. Tekanan gas dapat diatur dengan mengatur suhu dan volumenya. Dari penjelasan ini dapat diketahui bahwa gas memiliki besaran-besaran diantaranya adalah tekanan P, volume V dan suhu T. Hubungan ketiga besaran inilah yang dipelajari dalam bagian ini.
a. Hukum Boyle – Guy Lussac
Keadaan tekanan, volume dan suhu gas dimulai penjelasannya oleh Boyle. Boyle mengalami keadaan gas yang suhunya tetap. Pada saat gas ditekan ternyata volumenya mengecil dan saat volumenya diperbesar tekanannya kecil. Keadaan di atas menjelaskan bahwa pada suhu yang tetap tekanan gas berbanding terbalik dengan volumenya.
Persamaan di atas yang kemudian dikenal sebagai hukum Boyle.
Keadaan berikutnya dijelaskan oleh Guy Lussac. Menurut Guy Lussac, pada gas yang tekanannya tetap maka volumenya akan sebanding dengan suhunya. Jika ada gas dalam ruang tertutup dengan P = tetap dipanaskan maka volumenya akan berubah.
persamaan yang dapat menggambarkan keadaan perubahan P, V dan T (tidak ada yang tetap). Persamaan gabungan itulah yang dinamakan hukum Boyle-Guy Lussac. Persamaannya dapat kalian lihat di bawah.
b. Persamaan umum gas
Kalian tentu sering melihat balon yang ditiup. Meniup balon berarti menambah jumlah partikel. Pada saat itu volume benda akan bertambah. Berarti jumlah partikel sebanding dengan volumenya.
Kalian tentu sering melihat balon yang ditiup. Meniup balon berarti menambah jumlah partikel. Pada saat itu volume benda akan bertambah. Berarti jumlah partikel sebanding dengan volumenya.
Contoh kedua adalah saat memompa ban dalam roda sepeda atau mobil. Saat dipompa berarti jumlah partikelnya bertambah. Pertambahan itu dapat memperbesar tekanan sedangkan volume dan suhu tetap. Dari penjelasan itu terlihat bahwa 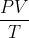 sebanding dengan jumlah partikelnya. Pembandingnya dinamakan konstanta Stefan-Boltzmann, dan disimbolkan k.
sebanding dengan jumlah partikelnya. Pembandingnya dinamakan konstanta Stefan-Boltzmann, dan disimbolkan k.
Dengan :
P = tekanan gas (N/m2 atau Pa)
V = volume gas (m3)
T = suhu gas (K)
N = jumlah partikel
k = 1,38 . 10-23 J/K
3. Azas Ekuipartisi
Setiap gas mengandung partikel-partikel yang selalu bergerak. Mengapa selalu bergerak? Partikel-partikel itu dapat bergerak karena memiliki energi. Energinya dinamakan energi kinetik.
“Jika pada gas berlaku hukum Newton maka semua derajat kebebasan gerak partikel akan menyumbang energi kinetik sebesar 1/2 kT.”
Dengan :
T = suhu gas (K)
f = derajat kebebasan
k = ketetapan Baltzum.
Aturan di atas itulah yang dikenal sebagai Azas ekuipartisi atau azas bagi rata.
a. Energi gaya monoatomik
Partikel-partikel gas monoatomik memiliki tiga derajat kebebasan. Berarti energi kinetik rata-rata partikelnya memenuhi persamaan berikut.
Dalam sejumlah gas dapat mengandung banyak partikel (N partikel). Setiap partikel tersebut memiliki energi, jumlah semua energi kinetik partikel-partikel itu dinamakan energi dalam gas dan disimbulkan U sesuai persamaan berikut.
b. Kecepatan efektif
adalah nilai rata-rata kecepatan partikel kuadrat. Jika diakarkan akan mendapatkan nilai yang dinamakan road mean square velsiti (vrms). Nilai akar rata-rata kuadrat dalam bahasa Indonesia dikenal sebagai nilai efektif. Jadi
Dengan :
vef = kecepatan efektif partikel
T = suhu gas (K)
m = massa partikel (kg)
k = 1,38 . 10-23 J/K







0 komentar:
Speak up your mind
Tell us what you're thinking... !